2024年4月,深圳大学医学部许兴智教授团队与山东大学汪兆琦教授团队合作,共同在国际顶级期刊PNAS发表题为“PARP1 UFMylation ensures the stability of stalled replication forks”的研究论文。这是许兴智教授团队继2019年首次诠释UFM1修饰(UFMylation)在DNA损伤应答(DDR)中促进DDR核心激酶ATM活化的分子机制后,再次率先揭示了UFM1修饰维持被阻滞复制叉的稳定性,进而维持基因组稳定性的作用机理。深圳大学医学部博士生龚亚民、助理教授王志峰和山东大学助理研究员宗文为共同第一作者,许兴智教授和汪兆琦教授为共同通讯作者,深圳大学为第一单位。
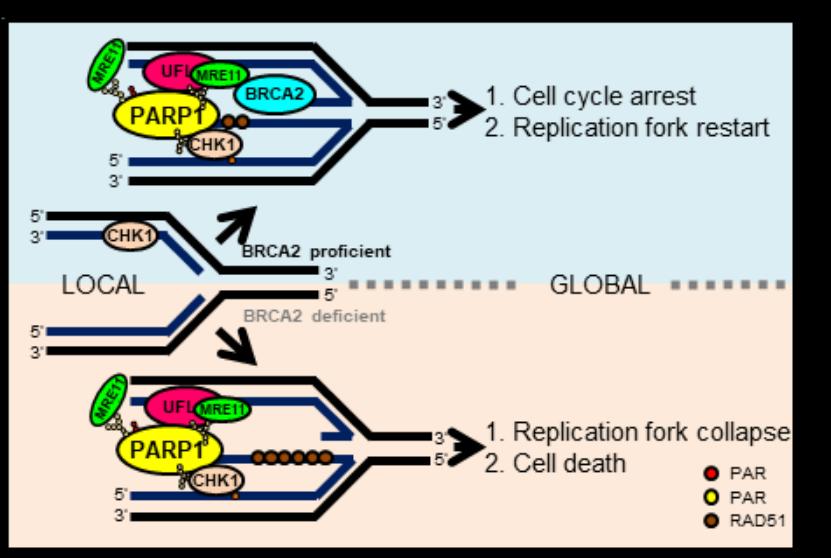
基因组DNA的高保真复制和合适的DNA复制胁迫应答是维持基因组稳定性和细胞增殖的根本保障,其异常与大多数肿瘤的发生和发展密切相关,因此,其调控网络也是肿瘤治疗的核心靶标。作为2004年才被发现的最新型类泛素修饰—UFM1修饰,至今被发现的修饰底物非常有限,却已被证明在胚胎发育、内质网稳态、蛋白质量控制、DDR等生命活动中起重要作用,然而在DNA复制胁迫应答中的功能尚有待挖掘。在该研究中,许教授团队发现UFM1修饰缺陷导致复制胁迫子下被阻滞的复制叉不稳定和染色体畸变率显著升高,进一步发现多聚(ADP-核糖)聚合酶PARP1的548位赖氨酸(K548)发生UFM1修饰,该修饰促进PARP1的酶性活化和在复制叉上的招募、细胞周期检验点激酶CHK1的激活和核酸酶MRE11到被阻滞复制叉的招募,进而促进BRCA1/2缺陷细胞中核酸酶MRE11对被阻滞复制叉的降解,而在BRCA1/2正常细胞中促进被阻滞复制叉重启,维持基因组稳定。肺癌病人的肿瘤细胞突变PARP1(F553L)展现出与UFM1修饰缺陷PARP1(K548R)相似的细胞表型。该研究成果揭示了UFM1修饰维持被阻滞复制叉稳定和基因组完整的作用机理,为基因组不稳定相关疾病的诊治提供了新的潜在策略。
据悉,浙江大学刘婷教授也在Nat Chem Biol杂志发文,揭示UFL1催化PTIP的UFM1修饰,从而维持被阻滞复制叉的稳定性。
该研究依托广东省基因组稳定性与疾病防治重点实验室平台,并获得了国家自然科学基金、国家重点研发计划、深圳科技创新委员会项目和“珠江人才计划”引进高层次人才的资助。
原文链接:https://doi.org/10.1073/pnas.2322520121
撰稿:王志峰 审核:许兴智
(更新于2024/4/25 8:50:00)